首页
ꄲ
从“看不见”到“能预警”:PET如何让阿尔兹海默症提前10年被发现
从“看不见”到“能预警”:PET如何让阿尔兹海默症提前10年被发现
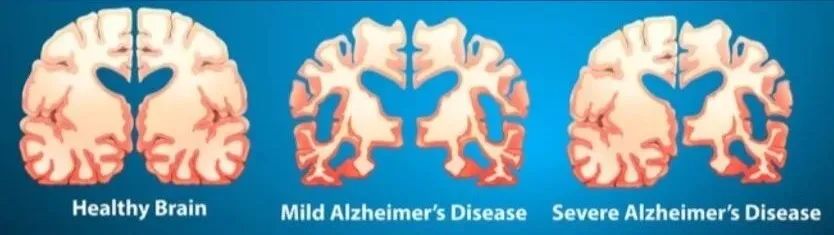
在许多人的印象中,阿尔兹海默症是一种“记忆一点点丢失”的退化性疾病。但在医学影像的视角下,它是一种“悄无声息地潜伏多年”的病理进程。研究表明,AD患者的大脑病变往往在症状出现前10~20年就已开始堆积,尤其是β-淀粉样蛋白(Aβ)与Tau蛋白的沉积。
问题是,在没有临床症状的情况下,我们如何识别出这些高风险人群?传统的神经心理测评无法发现这些隐匿性病变,而结构MRI等影像手段也常常“看不到”早期改变。
而如今,PET正成为突破这一瓶颈的关键技术。它不仅能“看到病变”,还能“预警趋势”,为阿尔兹海默症的早筛、早诊、早治打开新窗口。
阿尔兹海默病并非一夜之间发生,它的发展过程经历了多个生物学阶段,按照国际通行的“病理级联模型”来看,其过程如下:
1. β-淀粉样蛋白(Aβ)沉积:在大脑皮层间隙中缓慢堆积,是整个病理级联的“第一击”;
2. Tau蛋白异常磷酸化并聚集:从内嗅皮层向大脑其他区域扩展,标志着神经毒性启动;
3. 突触功能障碍与神经元丢失:患者出现代谢下降、功能衰退等信号;
4. 认知功能下降:临床可见的MCI或痴呆表现出现。
这些变化在体征上或许没有表现,但在PET影像中却能“提前现形”:
-
Aβ PET 可在症状出现前15~20年检出淀粉样病理;
-
Tau PET 可在症状前10年发现缠结病灶的区域性积聚;
-
FDG-PET 可以检测到代谢减退,反映神经元活性下降;
PET融合图像可将以上病理特征精准定位到大脑的解剖区域,如内嗅皮层、颞叶、海马等关键结构。美国DIAN研究网络对携带PSEN1突变的家族性AD高风险人群进行了为期十余年的PET随访,发现:
“Aβ PET阳性信号平均出现在症状前17年,Tau PET阳性在前10年左右开始积聚,并随着时间推移呈阶梯式传播。”
Benzinger TLS et al., J Nucl Med, 2023
这意味着,PET可以作为一种时间窗口分析工具,揭示患者当前处于哪一病理阶段,并估算其未来5~10年的风险趋势。此外,不同PET示踪剂的组合使用也带来了多维度的疾病“预警图谱”,例如:
湾影科技在实际客户应用中也观察到,PET不仅对症状明显的患者有诊断价值,在认知正常或轻微主观认知下降(SCD)阶段同样能发现潜在病理改变,为后续干预创造条件。
现代医学越来越强调“前移干预”,即在疾病尚未出现症状时,就通过生物标志物识别高风险个体。阿尔兹海默病正是这一理念的典型受益者,而PET影像正是连接“潜在病理”与“临床风险”的关键桥梁。
美国ADNI(Alzheimer’s Disease Neuroimaging Initiative)2023年的一项队列分析中,研究人员对超过1,200名认知正常老年人进行PET成像,发现:
-
其中约25%为Aβ PET阳性(即已存在显著斑块沉积);
-
这些Aβ阳性个体在随后的6年中,有38%进展为轻度认知障碍(MCI)或阿尔兹海默病;
-
-
如果患者在Aβ PET阳性的同时,Tau PET亦为阳性,则其3年内认知功能明显下降的风险高达62%。
这类数据意味着,PET不仅能检测“有病”,还能预测“几年后可能发病”的人,真正具备了前瞻性预警能力。
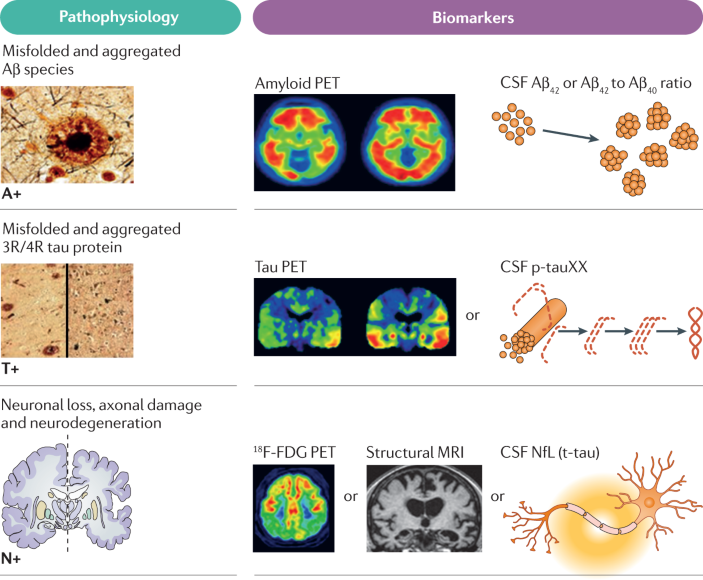
当前阿尔兹海默病的诊断和分期,不再局限于临床症状,而是依据三个核心生物标志物维度组成的“ATN框架”:
世界阿尔兹海默病协会已在2023年发布共识声明,推荐使用ATN模型评估认知正常人群的发病风险和早筛必要性,其中以PET为最重要的成像手段之一。
PET成为阿尔兹海默病新药的“体检官”:贯穿整个治疗路径
在过去十年中,全球阿尔兹海默病药物研发进入瓶颈期,众多试验因疗效不明或人群不准而失败。但2023年以来,多个以清除Aβ为靶点的单克隆抗体类药物(如 Lecanemab仑卡奈单抗、Donanemab多奈单抗)相继获批,标志着新药研发进入“病理靶向”阶段。
在这一新阶段,PET被正式纳入药物开发与临床应用的核心工具,并在以下三个环节发挥重要作用:
所有Aβ靶向抗体类药物的用药前提都是:患者必须确实存在大脑Aβ沉积,而不能仅凭临床症状。目前国际主流的筛查路径是:
3. 然后根据PET结果判断是否符合临床试验或正式用药入组标准。
在Lecanemab的III期试验CLARITY AD中,100%患者均经Aβ PET确诊病理阳性后纳入,保障了人群的靶点一致性,提升了药物疗效显著性【来源:NEJM, 2023】。
PET不仅用于筛选合适人群,更是监测新药疗效的“黄金标准”。PET能清晰量化药物使用前后Aβ或Tau负荷的变化,成为比认知测评更客观、反应更敏感的成像指标。
Lecanemab治疗18个月后,患者平均Aβ PET SUVR值下降约27%(从1.32降至1.01),且68%患者在PET影像上达到斑块清除标准,越早使用、清除越彻底者,认知退化速度下降幅度越大;
2024年初Donanemab试验结果显示,Tau PET增速亦受到抑制,提示药物可能间接延缓Tau蔓延过程;
临床试验中已逐步将PET定量数据作为辅助疗效终点,增强结果可信度。而对于日常临床医生而言,PET提供的定量参数(如SUVR、Z-score、病灶体积)也正在成为日后随访的重要参考。
随着抗Aβ抗体药物使用日益普及,其相关副反应也成为监管重点,尤其是ARIA(Amyloid-Related Imaging Abnormalities),包括脑微出血(ARIA-H)与脑水肿(ARIA-E)。FDA现已要求:
-
使用Aβ抗体药物的患者,必须定期进行PET或MRI监测;
-
2024年,FDA批准的AI工具“IcoBrain Amyloid ARIA检测系统”可辅助医生在PET图像中识别ARIA风险,显著提高发现敏感性和解读一致性【来源:Radiology, 2024】.对于基层医院或普通神经内科医生而言,这类工具将大幅提升PET的“可用性”和“安全把控力”。
正因如此,美国国家医保(CMS)于2024年初宣布:不再限制Aβ PET检查的报销次数,并允许单独支付高价PET示踪剂,体现了对PET在临床治疗流程中不可替代价值的认可。
湾影观点|PET:认知疾病“可视化管理时代”的基础设施
从过去“确诊疾病”,到现在“预测风险”,再到未来“全程管理”,PET的角色已经悄然发生转变。它不仅是一种高精尖影像技术,更是构建未来认知障碍防控体系的关键基石:
-
没有PET,我们可能只能在症状明显时才知道问题的存在;
-
有了PET,我们才有可能在“尚未健忘”时就精准预警;
-
联合AI之后,它甚至可以自动告诉我们——“接下来几年你会发生什么”。
PET不仅可以“让我们看得见”,更将成为“我们提前干预疾病进程”的核心凭证。湾影科技将继续助力PET走进早期筛查、走进老年健康管理体系、走进新药的全生命周期之中。我们相信,未来10年认知疾病领域真正的转折点,不只是某一款药物的成功,而是——我们有没有能力,在疾病真正开始前10年,就发现它。
1.Alzheimer’s Disease Neuroimaging Initiative (ADNI) Summary Report, 2024.
2.Benzinger TLS et al. (2023). Longitudinal PET Biomarker Changes in DIAN. J Nucl Med.
3.Jack CR et al. (2023). ATN Framework Validation in ADNI 4. Alzheimer’s & Dementia.
4.Ritchie CW et al. (2024). AI-enhanced Prediction of AD. The Lancet eClinicalMedicine.
5.van Dyck CH et al. (2023). Lecanemab in Early Alzheimer’s Disease. NEJM.
6.Radiology (2024). FDA-Approved AI Tool for ARIA Detection. doi:10.1148/radiol.231216
7.SNMMI & Alzheimer’s Association. (2024). Appropriate Use Criteria for Amyloid and Tau PET.
8.CMS. (2024). Reimbursement Policy Update for Amyloid PET Imaging.